Terapie anti-CD20 monoklonálními protilátkami je zásadní léčebnou modalitou u celé řady autoimunitních onemocnění, včetně roztroušené sklerózy (RS), a to zejména u relabující a primárně progresivní formy. V souvislosti se sekundárně vzniklou imunodeficiencí na podkladě biologické terapie vystupují zvláště biologická léčiva cílící na B lymfocyty. U části pacientů se v těchto případech rozvíjí různý, i závažný, stupeň sekundární imunodeficience (SID) hlavně v oblasti protilátkové. V terapii takových stavů se potom uplatňuje substituce imunoglobulinů.
Problematice hypogamaglobulinémií u pacientů s RS léčených anti-CD20 monoklonálními protilátkami jsou věnovány M&M Days, které se budou konat 23.-24. května 2025 v Praze. Všichni, které toto téma zajímá, jsou srdečně zváni.
V imunopatogenezi RS se v poškozujícím zánětu významně uplatňují B lymfocyty, které jsou schopny prostřednictvím specifických receptorů rozpoznávat (auto)antigeny. K jejich aktivaci a klonální expanzi významně přispívají rovněž receptory PRR (Pattern recognition receptors), identifikující vzory vnitřního poškození DAMP (Damage Associated Molecular Pattern) a(nebo) vzory mikrobiální invaze PAMP (Pathogen Associated Molecular Pattern). V CNS nemocných s RS byly prokázány organizované lymfatické struktury tvořené především B lymfocyty v různém stupni diferenciace a aktivace. V poškozujícím zánětu u nemocných s RS jsou B lymfocyty účinnými buňkami, které předkládají antigeny T lymfocytům a přispívají k jejich abnormální funkční polarizaci. Jsou rovněž zdrojem spektra prozánětlivých cytokinů. Podstatný podíl B lymfocytů v patofyziologii RS je doložen experimenty na zvířecích modelech. Zásadním důkazem je však klinicky prokázaná vysoká účinnost biologik, které cílí na molekulu CD20 B lymfocytů, v léčbě nemocných s RS.
Prvním a stále stěžejním přípravkem biologické terapie cílené na B buňky je rituximab, monoklonální protilátka proti CD20. Rituximab byl objeven v roce 1991 a poté byl používán v klinických studiích od roku 1993, což skýtá již dostatečně dlouhou historii k pozorování klinických a dalších účinků, včetně mapování sekundární imunodeficience navozené deplecí B lymfocytů. Rituximab není u RS oficiálně schválen, ale na podkladě provedených studií se používá off label. Pro léčbu nemocných s RS jsou schválena biologika ocrelizumab a ofatumumab.
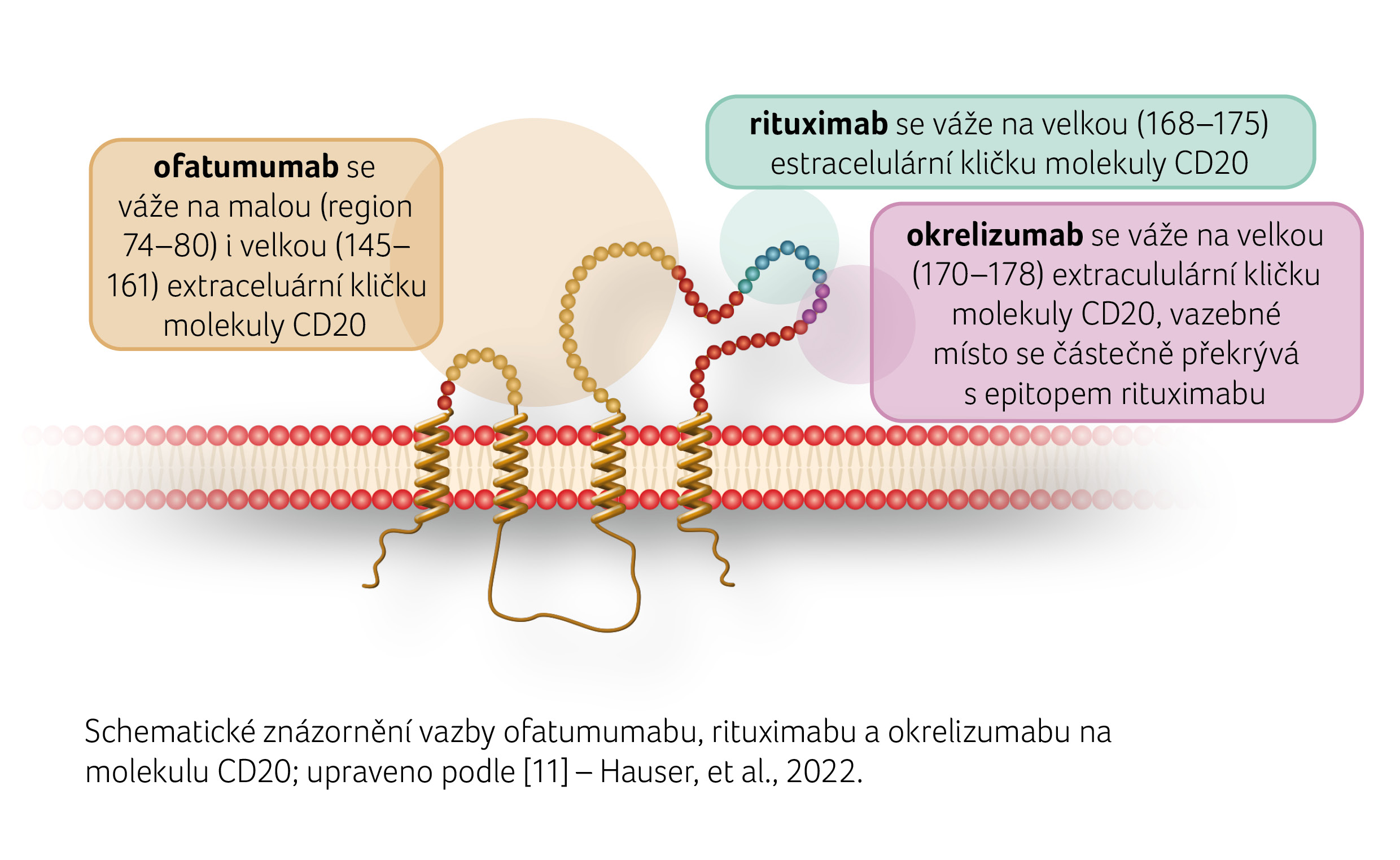
Molekula CD20, která byla objevena v roce 1980 jako první marker B-lymfocytů, je detailně popsána. Jedná se o povrchovou membránovou molekulu, která hraje úlohu iontového kanálu řídícího metabolismus vápníku spojený se signalizací B-buněčného receptoru. Molekula CD20 je tak slibným cílem B-depleční léčby u onemocnění spojených s narušenou funkcí B-lymfocytů. Léčba biologiky anti-CD20 však ovlivňuje B lymfocytární systém natolik, že u některých nemocných může docházet ke snížení plazmatické hladiny imunoglobulinů k dolní fyziologické hranici.
Pacienti s RS, u nichž se po léčbě okrelizumabem nebo ofatumumabem vyvinula hypogamaglobulinémie, mají přibližně dvojnásobně vyšší riziko závažné infekce. Tito pacienti, u kterých dochází po B-depleční léčbě k poklesu sérové koncentrace IgG, mají vyšší riziko hospitalizace, nutnosti intravenózní aplikace antibiotik a prodloužené doby jejich podávání. Spektrum infekčních komplikací zahrnuje hlavně infekce respiračního traktu a infekce močových cest. Mezi nejvýznamnější rizikové prediktory pro hypogamaglobulinémii a závažné infekce patří vyšší věk pacientů léčených anti-CD20 monoklonálními protilátkami, snížená koncentrace IgG a IgA před B-depleční léčbou a lymfopenie.
Základním terapeutickým přístupem u pacientů se sekundárním protilátkovým imunodeficitem po B-depleční terapii je imunoglobulinová substituční léčba. Ta je indikována u pacientů se závažnou hypogamaglobulinémií se sérovými koncentracemi IgG < 4 g/l nebo v případě selhání specifické postvakcinační odpovědi. Před samotnou imunoglobulinovou substituční léčbou je vždy třeba zvážit antibiotickou profylaxi. Cílovou sérovou koncentrací je hodnota IgG 5-7 g/l. Imunoglobulinovou substituci lze podávat intravenózně (IVIG) nebo subkutánně (SCIG).
V případě sekundárních protilátkových imunodeficiencí s klinickou manifestací imunodeficience existují pozitivně vyznívající studie ukazující na pozitivní efekt použití imunoglobulinové substituce u nemocných s chronickou lymfatickou leukémií a s mnohočetným myelomem. Pro celou řadu sekundárních hypogamaglobulinémií, kde je imunoglobulinová substituce celosvětově doporučena a využívána, ale chybí jednoznačné důkazy. Patří sem zejména závažné sekundární poruchy tvorby protilátek po imunosupresivní léčbě, nejčastěji po použití biologické léčby zaměřené proti B-lymfocytům. Z hlediska indikace a účinnosti léčby není žádný důvod, proč by měl být rozdíl mezi primárními imunodeficiencemi a sekundárními hypogamaglobulinémiemi způsobenými poruchou tvorby protilátek. Tomu odpovídá i doporučení EMA z roku 2021, dle kterého je intravenózní imunoglobulinová substituční léčba doporučována u sekundárních imunodeficiencí u pacientů, kteří trpí závažnými nebo opakovanými bakteriálními infekcemi, antibiotická léčba je u nich neúčinná a je u nich prokázáno selhání specifických protilátek nebo mají hladinu IgG v séru < 4 g/l. V České republice se postupně na základě klinických zkušeností ustanovil konsenzus, který jako Návrh standardu imunoglobulinové léčby nemocných s protilátkovými imunodeficienciemi vydal výbor ČSAKI (Česká společnost pro alergologii a klinickou imunologii). Dle tohoto doporučení je zahájení substituční imunoglobulinové terapie indikováno v případech, kdy je prokázána významná hypogamaglobulinémie spojená s infekčními komplikacemi a s poruchou specifické protilátkové odpovědi. Substituční léčba se potom řídí stejnými pravidly, která platí pro substituci v dalších indikacích.
I u sekundárních imunodeficiencí jsou k dispozici imunoglobulinové přípravky pro intravenózní (IVIG) či subkutánní (SCIG) použití. Volba vhodné eventuality se řídí základní diagnózou, tíží imunodeficience a tím i odpovídající dávky přípravku a zvážením celkové klinické i sociální situace daného pacienta. IVIG a SCIG mají některé odlišné vlastnosti, které je při výběru imunoglobulinu pro konkrétního pacienta a jeho onemocnění vhodné zohlednit. Je to například profil nežádoucích účinků, farmakokinetika, možnost podání určitých objemů IgG a biologická dostupnost. Vlastnosti SCIG a IVIG jsou kombinovány u SCIG s facilitovaným podáním, kdy podání velkých objemů imunoglobulinů umožňuje předchozí aplikace enzymu lidské rekombinantní hyaluronidázy, která rozšiřuje aplikační prostor v podkoží. Léčba je vždy nastavena v intenzivní spolupráci s pacientem a jeho rodinou. Dávky se volí tak, aby bylo dosaženo účinných koncentrací IgG v pásmu věkové normy. U hluboké hypogamaglobulinémie potom je možné používat dávky doporučené pro závažné primární protilátkové deficity, které jsou 400–600 mg/kg/měsíc imunoglobulinového přípravku. Výjimečně jsou doporučeny i dávky vyšší. Dávkování je poté sledováno a upravováno podle monitorování koncentrací IgG a podle klinického stavu pacienta. Doba podávání se opětovně řídí individuálně. Pro velkou rozdílnost v základní diagnóze, ve formě terapie, která imunodeficienci způsobila, a v nutnosti případného opakování B deplečních a dalších terapií není možné stanovit obecná striktní pravidla.
Údaje o rozvoji hypogamaglobulinémií a infekcí u více než 19 000 pacientů s RS léčených anti-CD20 monoklonálními protilátkami uvádí systematický přehled literatury, který byl publikován počátkem letošního roku. Poskytuje komplexní analýzu vlivu anti-CD20 léčiv na sérové hladiny IgG u pacientů s RS a zkoumá prevalenci hypogamaglobulinémie na základě různých typů léčiv, délky léčby a typů infekcí. Celková míra prevalence hypogamaglobulinémie byla zjištěna na úrovni 11 %. Analýza podskupin podle typu léku odhalila různou míru prevalence, přičemž nejvyšší byla u rituximabu, a to 18 %. Analýza podskupin založená na délce užívání léku odhalila, že nejvyšší podíl hypogamaglobulinémie se vyskytoval u jedinců užívajících léky 1 rok nebo méně (19 %). Prevalence infekcí u pacientů s RS se zaměřením na různé typy infekcí stratifikovaných podle užívaného léku na RS ukázala, že nejčastější jsou plicní infekce (9 %), následované infekcemi močových cest (6 %), gastrointestinálními infekcemi (2 %) a infekcemi kůže a sliznic (2 %). Kromě toho byl zjištěn významný pokles průměrných hladin IgG po léčbě ve srovnání s hladinami před léčbou, přičemž průměrný rozdíl činil 0,57.
Studie přispívá cennými poznatky o imunosupresivních účincích, rizicích infekce a důsledcích anti-CD20 terapie při léčbě RS. Celé znění práce je dostupné zde:
https://www.frontiersin.org/journals/neurology/articles/10.3389/fneur.2024.1380654/full
Závěr
Anti-CD20 terapie hraje významnou roli v léčbě pacientů s RS, především s relabujícími a primárně progredujícími formami. Sekundární imunodeficience navozené biologickou terapií namířenou na depleci B lymfocytů se laboratorně a klinicky projevují u přibližně 10 % pacientů. Vyšší věk pacientů, snížená koncentrace IgG a IgA před léčbou, lymfopenie a prolongované podání anti-CD20 terapie představují nejvýznamnější rizikové faktory. Terapie navozené hypogamaglobulinémie se provádí intravenózní či subkutánní substitucí imunoglobulinů za monitorování koncentrací IgG tak, aby bylo dosaženo referenčních hodnot a zároveň klinické účinnosti.
Reference
- Elgenidy A. et al., Hypogammaglobulinemia and infections in patients with multiple sclerosis treated with anti-CD20 treatments: a systematic review and meta-analysis of 19,139 multiple sclerosis patients. Front Neurol. 2024 Apr 18; 15:1380654. doi: 10.3389/fneur.2024.1380654.
- Výbor ČSAKI. Návrh standardu imunoglobulinové léčby nemocných s protilátkovými imunodeficienciemi. Alergie 2016; 18: 29–30.
- Milota T., Terapie anti-CD20 monoklonálními protilátkami v neurologii z pohledu imunologa, Farmakoterapuetická revue, 4/2024
- Šedivá A., Sekundární imunodeficience indukované biologickou léčbou, Remedia 2018; 28: 407–410.
- https://www.ema.europa.eu/en/clinical-investigation-human-normal-immunoglobulin-intravenous-administration-ivig-scientific-guideline