V současné době je všeobecně uznáváno, že časné zahájení chorobu modifikující terapie (DMT) je spojeno s lepší dlouhodobou prognózou. Otázka, kdy a jak deeskalovat nebo ukončit DMT, však zůstává stále otevřená. Tato problematika byla diskutována na workshopu ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis) v roce 2023, jehož cílem bylo poskytnout praktická doporučení založená na důkazech pro léčbu a sledování deeskalace DMT, a je předmětem tohoto přehledu.
Cílem DMT se postupně stalo dosažení úplné kontroly nad zánětlivou složkou onemocnění, nikoliv pouhé snižování frekvence relapsů. Současné terapeutické algoritmy se neustále zdokonalují, přičemž je akceptováno, že větších přínosů DMT v prevenci relapsů a zpoždění progrese lze dosáhnout při včasném zahájení účinné léčby. Výběr DMT se řídí hodnocením přínosů a rizik, které je podpořeno diskusí mezi eskalací a časnými vysoce účinnými terapeutickými režimy.
Většina DMT pro RS se podává kontinuálně. Mezi tyto udržovací terapie patří interferon beta (IFNβ), glatiramer acetát (GA), teriflunomid (TRF), dimethyl fumarát (DMF)/diroximel fumarát (DRF), jakož i „vysoce účinné terapie“ (HET), včetně anti-CD20 protilátek a léčiv cílených na transport imunitních buněk, jako je natalizumab (NTZ) a modulátory sfingosin-1-fosfátového receptoru (S1PR). Alternativou k těmto udržovacím terapiím je podávání HET buď jednorázově, nebo sekvenčně, čímž lze dosáhnout vyšší adherence k léčbě a nižšího rizika dlouhodobých kumulativních nežádoucích účinků spojených s chronickou imunosupresí. Do této kategorie, známé také jako imunitní rekonstituční terapie (IRT), patří kladribin (CLA), alemtuzumab (ALZ), mitoxantron (MTX) a autologní transplantace krvetvorných kmenových buněk (AHSCT).
Kromě optimálního výběru DMT je třeba vytvořit algoritmy deeskalace, které by odůvodňovaly pravidelné přehodnocování léčebných plánů s cílem snížit intenzitu léčby, nebo ji dokonce ukončit, pokud se poměr přínosu a rizika stane méně příznivým. V této souvislosti je pochopení zásad, problémů a vyvíjejících se důkazů týkajících se strategií deeskalace zásadní pro optimalizaci dlouhodobých výsledků, zmírnění rizik a zlepšení kvality života osob s RS. Doposud však ohledně strategií deeskalace nebo ukončení léčby neexistuje shoda.
Deeskalační strategie se obvykle vztahují na přechod z jednoho přípravku DMT na méně účinný, ale může se také jednat o snížení dávky nebo prodloužení dávkovacího intervalu. Ukončení DMT, ať už trvalé, nebo dočasné (např. v době těhotenství), sdílí s deeskalačními strategiemi problémy s výběrem pacientů a sledováním. Strategie deeskalace platí pro všechny typy DMT. U imunitních rekonstitučních terapií lze deeskalaci dokonce považovat za součást jejich mechanismu účinku, protože se očekává, že navodí prodlouženou remisi bez další DMT nebo s méně účinnou udržovací léčbou.
Hlavním důvodem pro změnu nebo ukončení DMT je změna rovnováhy mezi přínosem a rizikem u daného pacienta. To může souviset se snížením očekávané účinnosti a/nebo se zvýšením rizik spojených s léčbou nebo s hostitelem. V obou případech hrají zásadní roli změny imunitního systému související s věkem.
Imunosenescence, inflamm-aging a jejich význam pro RS
Imunosenescence (ISe) a inflamm-aging (IA) představují dva klíčové procesy spojené se stárnutím, které ovlivňují imunitní funkce. ISe se projevuje postupným poklesem funkce imunitního systému, zejména změnami v T a B lymfocytech a protilátkách, zatímco IA je charakterizován chronickým nízkým stupněm zánětu. Tyto procesy mohou vést k vyšší incidenci rakoviny a infekcí a ke snížené odpovědi na očkování u starších jedinců. Dále se ukazuje, že makrofágy/mikroglie CNS mají tendenci diferencovat se do prozánětlivého fenotypu, který ovlivňuje sousední buňky a přispívá k poškození tkáně. Stále více důkazů naznačuje, že na RS by mělo být lépe nahlíženo jako na kontinuum s různým podílem zánětlivých a neurodegenerativních procesů u jednotlivých osob a v průběhu času.
Relapsy jsou spojeny s fokálními demyelinizačními lézemi souvisejícími s infiltrací periferních imunitních buněk (především T a B buněk) přes hematoencefalickou bariéru (BBB). Během progresivní fáze RS je periferní imunitní postižení sekundární k difuznímu a kompartmentalizovanému zánětu CNS, kterému dominuje mikrogliální aktivace a meningeální infiltrace. Oba procesy korelují s difuzní neuroaxiální ztrátou, která je považována za hlavní podklad progresivního postižení u RS. U pacientů s RS se tak postižení může rozvinout buď v důsledku zhoršení souvisejícího s relapsem, nebo progrese nezávislé na aktivitě relapsu (PIRA). Nedávno se ukázalo, že PIRA začíná v časné fázi onemocnění, a to i u relabující-remitující formy (RR RS), a stává se hlavní příčinou kumulace postižení s rostoucím věkem a délkou trvání onemocnění. ISe a IA tedy mohou hrát roli jak v poklesu fokální zánětlivé aktivity a v progresivní neurodegeneraci pozorované s rostoucím věkem u pacientů s RS, tak v rozdílné účinnosti a rizicích DMT.
Otázky týkající se bezpečnosti
Vzhledem k tomu, že všechny DMT ovlivňují imunitní systém, je nejčastějším bezpečnostním problémem riziko infekcí. ALZ, AHSCT a intravenózní anti-CD20 přípravky jsou ve srovnání s jinými DMT spojeny se zvýšenou frekvencí závažných infekcí (tj. vyžadujících hospitalizaci). Riziko infekce u rituximabu (RTX) je významně spojeno s věkem, stupněm postižení, obezitou, lymfopenií, hypogamaglobulinemií a délkou léčby, přičemž tyto faktory jsou na sobě nezávislé.
Hypogamaglobulinemie souvisí také s kumulativní dávkou intravenózních B deplečních látek (RTX a OCR). Na druhé straně vyšší kumulativní dávky RTX zvyšují riziko infekce i v případě normálních hladin imunoglobulinu G (IgG). Celkově se jako nejdůležitější rizikový faktor pro závažné infekce při léčbě RTX ukázala míra postižení, což je pravděpodobně relevantní i pro ostatní anti-CD20 léčiva.
U starších pacientů léčených NTZ, FTY (fingolimod) nebo DMF je zvýšené riziko oportunních infekcí, jako je progresivní multifokální leukoencefalopatie (PML) způsobená infekcí JC virem. Prokázaným rizikovým faktorem PML je také léčba NTZ delší než dva roky. Se stářím a délkou léčby rovněž souvisí riziko kryptokokové meningitidy při léčbě FTY a vyšší riziko lymfopenie vyvolané DMF a delší dobou do repopulace lymfocytů po ukončení léčby.
Odpověď na vakcíny, včetně vakcíny proti covidu-19, je oslabena některými DMT (modulátory S1PR, B depleční terapie) a ke snížené účinnosti vakcín může rovněž přispívat ISe.
Celkový výskyt rakoviny je srovnatelný s výskytem v běžné populaci, což znamená, že se zvyšuje s věkem. S věkem se také zvyšuje sklon ke kumulaci komorbidit, které mohou zvyšovat riziko interakcí mezi DMT a léčbou těchto komorbidit, ale i specifická rizika DMT.
Pro dlouhodobé riziko sekvenčního užívání léků s různými mechanismy účinku neexistuje dostatek důkazů, ačkoli nedávná studie nezjistila žádný významný vliv předchozí expozice DMT na riziko infekce RTX.
Potenciální rizika deeskalace léčby u RS
Rebound fenomén
Rebound fenomén (RF) obvykle označuje zvýšení aktivity onemocnění po ukončení léčby DMT, dosud však nemá jednotnou definici. Projevuje se zvýšením míry relapsů a/nebo aktivitou na magnetické rezonanci (MR). Někteří autoři navrhli dodatečná kritéria, jako jsou závažné relapsy spojené s trvalým zvýšením skóre EDSS (Expanded Disability Status Scale), nové T2 léze a gadolinium enhancující léze na MR.
Případy RF byly popsány po ukončení léčby DMT ovlivňující buněčný transport, jako je NTZ a FTY, přičemž hlavním mechanismem je rychlý návrat lymfocytů do CNS. Riziko RF po ukončení léčby jinými modulátory S1PR není dostatečně objasněno; dosud byl zaznamenán pouze jeden případ po vysazení siponimodu.
Riziko zrychlení progrese
Nedostatek informací o důvodech ukončení léčby u srovnatelných pacientů zůstává významnou limitací pro hodnocení a výsledky studií jsou protichůdné.
Starší pacienti s RS
U starších pacientů s RS je relaps velmi vzácný, ale je spojen s horšími výsledky po relapsu. Tento pokles schopnosti zotavení může být způsoben sníženou kapacitou remyelinizace a neurodegenerativními procesy spojenými se stárnutím.
Dočasná deeskalace spojená s plánovaným nebo probíhajícím těhotenstvím
Studie ukazují, že míra relapsů během těhotenství klesá. Někteří lékaři mají tak tendenci DMT před početím systematicky vysazovat, jiní DMT nezahajují v případě krátkodobého plánu těhotenství. Ochranný účinek těhotenství však není vždy dostatečný k tomu, aby zabránil reaktivaci onemocnění, nebo dokonce RF, a to zejména u žen, které přestanou užívat DMT ovlivňující buněčný transport. Rozhodnutí o léčbě je třeba individualizovat, sdílet je s pacientkami a jejich partnery a pokud možno je předvídat. Důležité je, že každá volba DMT pro ženu v plodném věku musí zohlednit její plánování rodiny.
Strategie deeskalace v závislosti na typu DMT
Fingolimod a další modulátory S1PR
Fingolimod (FTY) a další modulátory S1PR představují významné riziko relapsu nebo RF při náhlém ukončení léčby. Z tohoto důvodu jsou pacienti léčení FTY málo zastoupeni v observačních studiích o ukončení léčby a byli vyloučeni z klinické studie STOP-I-SEP.
Ve studii Jouvenota a kol. u 64 pacientů starších 50 let, kteří přestali užívat FTY bez přechodu na jinou léčbu po nejméně dvou letech bez aktivity onemocnění, byl poměr rizika (HR) 4,5 pro relaps v roce po ukončení léčby ve srovnání se skupinou pokračující v léčbě. Studie 685 pacientů z registru MS Base zjistila, že přechod z FTY na základní léčbu byl spojen s vyšší mírou relapsů než přechod na HET. V observační studii 1 045 pacientů, kteří přešli z FTY, byla roční míra relapsů (ARR) 0,67 pro OCR a 2,31 pro kladribin (CLA) ve srovnání s NTZ. Jako zajímavá možnost budoucí deeskalace se tedy jeví „překlenovací“ léčba anti-CD20 látkami. Někteří neurologové navrhují po ukončení podávání FTY podat jednorázovou infuzi OCR, aby se předešlo riziku RF, ale v literatuře zatím nejsou k dispozici údaje, které by tuto strategii podporovaly.
Náročným bodem je délka wash-out periody. Riziko relapsu se totiž výrazně zvyšuje po dvou měsících vymývání; ve studii Roose a kol. dokonce po jednom měsíci. K překlenutí wash-out periody byly navrženy vysoké dávky kortikosteroidů, zejména pokud přetrvávající lymfopenie brání zahájení jiné léčby, ale tato strategie nebyla systematicky hodnocena. Někteří autoři navrhli postupné vysazení fingolimodu s nahrazením (nebo bez nahrazení) jinou terapií, avšak tato metoda dosud nebyla dostatečně zdokumentována.
Natalizumab
Ukončení léčby NTZ bez přechodu na jinou léčbu se nedoporučuje, protože je spojeno s vysokou mírou relapsu nebo RF. Dokonce i v kontextu stability onemocnění po dobu dvou let nebo déle u osob starších 50 let léčených NTZ bylo přerušení léčby spojeno s mnohem vyšším rizikem relapsu, a to v roce následujícím po vysazení léčby ve srovnání se skupinou pokračující v léčbě. Pokračování v léčbě NTZ s prodlouženým intervalem dávkování může být přijatelnou možností pro pacienty negativní na anti-JCV protilátky nebo pozitivní s indexem pod 0,9. Zdá se totiž, že účinnost na riziko relapsu zůstává zachována při dávkování 6 týdnů s možným snížením rizika PML u anti-JCV pozitivních pacientů s RS.
Strategii ukončení léčby NTZ hodnotil systematický přehled Sellnera a kol., kde se IFNβ a GA ukázaly jako nedostatečné pro prevenci reaktivace RS u většiny pacientů. DMF může být vhodnou volbou pro pacienty s nízkou aktivitou onemocnění před zahájením NTZ. Data o TRF jako strategii ukončení NTZ jsou omezená. FTY byl nejvíce studovanou terapií po NTZ, přičemž přechod na FTY byl spojen s nižším počtem relapsů než před zahájením NTZ. Přechod na anti-CD20 terapie, jako je RTX a OCR, vykázal velmi nízké procento relapsů po ukončení NTZ. Důkazy pro pulzy metylprednisolonu jsou omezené.
Délka wash-out periody kratší než tři měsíce je spojena s nižším rizikem relapsu. Protokol s postupným snižováním dávkování NTZ byl spojen s nižší mírou relapsu ve srovnání s přímým přechodem na jinou léčbu. Důležité je také monitorování rizika PML u pacientů pozitivních na JC virus po ukončení léčby NTZ.
Anti-CD20 látky
V retrospektivní studii zahrnující 92 pacientů s RR RS nebylo zjištěno, že ukončení léčby RTX z jakéhokoli důvodu bylo spojeno s rizikem RF nebo s významným návratem aktivity onemocnění po 14 měsících sledování. Studie Jouvenota a kol. ukázala, že riziko relapsu v roce po ukončení léčby RTX nebo OCR u pacientů starších 50 let bylo podobné jako u těch, kteří v léčbě pokračovali. To naznačuje, že ukončení léčby může být zváženo u určitých pacientů, zejména těch, kteří splňují kritéria věku nebo stability onemocnění.
V současnosti nejslibnější strategií deeskalace anti-CD20 je snížení dávky a/nebo prodloužení intervalů mezi infuzemi. Důkazy naznačují, že účinek intravenózních anti-CD20 agens může trvat mnohem déle, než se dosud předpokládalo. Otázka, kdy lze interval mezi infuzemi prodloužit na více než šest měsíců, však zůstává nevyřešena. Potenciální přínos prodloužených dávkovacích intervalů pro plánování očkování nebo těhotenství je zřejmý, přičemž jedním z hlavních cílů této strategie je také snížení rizika infekcí. V neposlední řadě nelze vyloučit, že prodloužení dávkovacího intervalu má negativní vliv na procesy spojené s progresí RS.
Imunitní rekonstituční terapie (IRT)
Na rozdíl od udržovací léčby se IRT, mezi něž patří CLA, MTX, ALZ a AHSCT, aplikují jednorázově nebo v krátkých intermitentních cyklech. Cílem IRT je eliminovat patogenní imunitní repertoár prostřednictvím intenzivní krátkodobé imunosuprese nebo deplece imunitních buněk a následně rekonstituovat nový imunitní systém s nadějí na obnovení imunitní tolerance. Přestože IRT snižují riziko kumulativních nežádoucích účinků spojených s chronickou imunosupresí, vystavují pacienty většímu množství rizik spojených s léčbou na jejím začátku. Mezi časné nežádoucí účinky patří febrilní neutropenie a infekční komplikace, které jsou primárně spojeny s pulzní imunosupresí. Pozdní nežádoucí účinky zahrnují rozvoj sekundárních autoimunitních onemocnění, zejména po terapii ALZ a AHSCT.
Deeskalace je nedílnou součástí přístupu IRT, neboť udržení remise může být dosaženo po dlouhou dobu. Nicméně, aktivita onemocnění a progrese postižení se mohou znovu objevit, což zdůrazňuje potřebu pravidelného klinického a zobrazovacího sledování. Podle dat z klíčových klinických studií dosáhlo po dvou letech stavu NEDA-3 (absence relapsů, zhoršení skóre EDSS a MR aktivita) pouze 58 % pacientů léčených ALZ a 44 % pacientů léčených CLA; nicméně po AHSCT dosáhlo stavu NEDA-3 60–90 % pacientů.
V současnosti existuje omezený konsenzus ohledně managementu pacientů, kteří po IRT vykazují aktivitu onemocnění, včetně opětovného nasazení jiné/nové DMT nebo opětovného nasazení IRT. MTX se nyní používá mnohem méně, avšak zůstává zajímavou možností jako indukční lék (měsíčně po dobu 6 měsíců) před dlouhodobým podáváním jiných, bezpečnějších DMT u pacientů s vysoce aktivní RR RS, zejména v zemích s nízkými příjmy.
Deeskalační strategie v závislosti na specifických podmínkách
Těhotenství
Rostoucí počet důkazů o expozici lékům během těhotenství a kojení umožňuje lépe posoudit přínos a riziko pro matku i plod a vydat doporučení pro léčbu DMT v tomto kontextu.
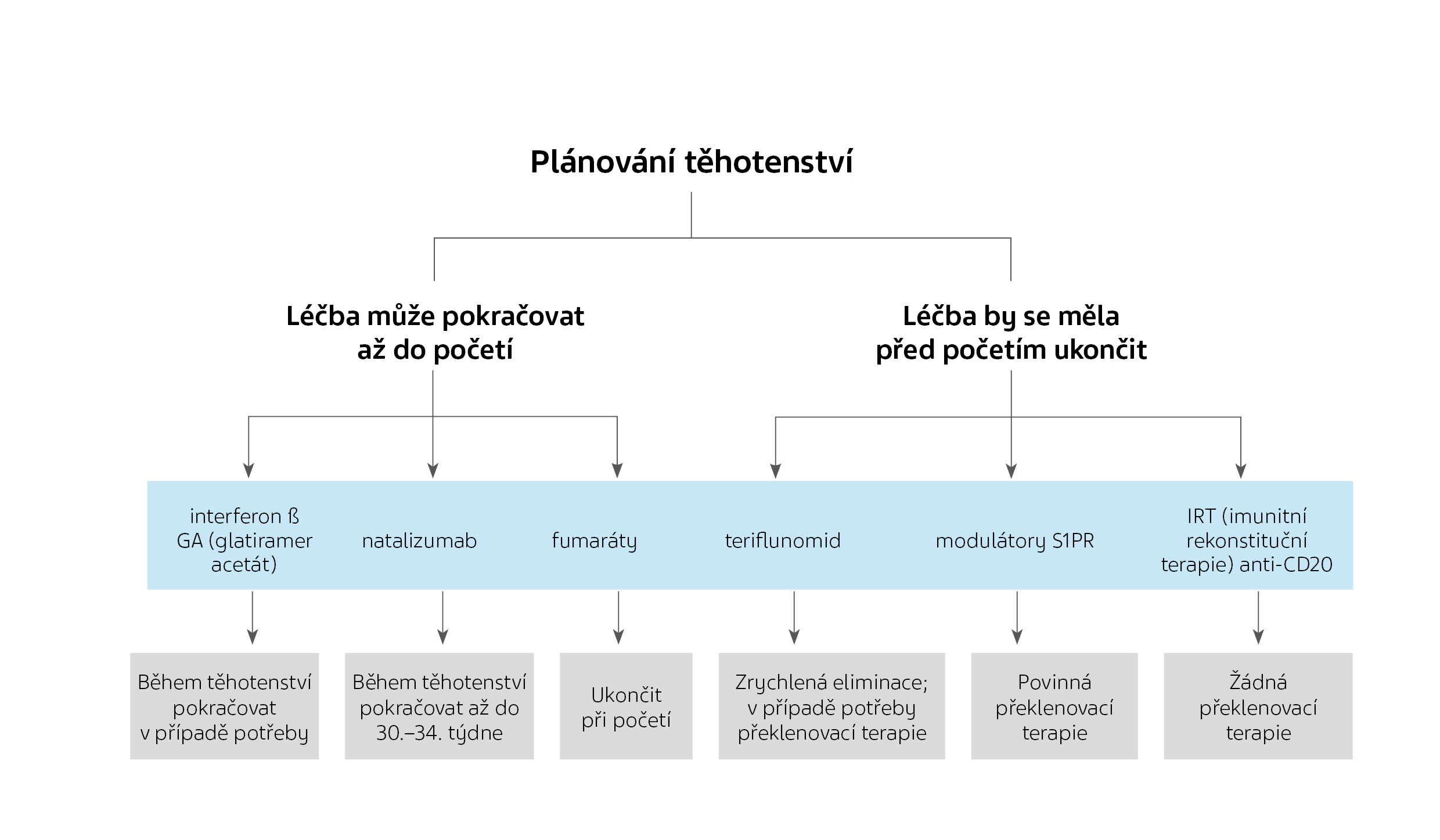
Pokud jde o problémy týkající se plodu, není třeba injekční léčbu první linie přerušovat před početím a lze v ní pokračovat i během těhotenství. Fumaráty lze vzhledem k jejich velmi krátkému poločasu a nedostatku důkazů o teratogenitě používat až do potvrzení těhotenství. Naopak modulátory S1PR a TRF by měly být před početím vysazeny, přičemž wash-out perioda závisí na každém konkrétním léku.
NTZ lze podávat až do konce druhého trimestru (až do 30.–34. týdne), ale během třetího trimestru může NTZ zvyšovat riziko reverzibilních hematologických abnormalit u novorozenců.
Doporučení EMA (Evropská léková agentura) a FDA (americký Úřad pro kontrolu potravin a léčiv) varují před těhotenstvím šest až osm měsíců po poslední infuzi anti-CD20. Protože však OCR a RTX neprocházejí placentární bariérou během prvního trimestru a jsou odstraněny v průměru za pět měsíců, těhotenství by teoreticky mohlo být myslitelné za dva měsíce po poslední infuzi. Vzhledem k tomu, že rychlost jejich eliminace je různá, někteří doporučují počkat tři až čtyři měsíce. Podobně u ofatumumabu (OFA) s poločasem rozpadu 16 dní by se mohlo pokračovat až do potvrzení těhotenství. Hlavním rizikem je výskyt hematologických nebo imunologických účinků (a potenciální kontraindikace pro živé vakcíny) u novorozenců vystavených působení anti-CD20 látek během střední nebo pozdní fáze těhotenství. V případě IRT by měla být poslední dávka CLA a ALZ podána nejméně šest měsíců, resp. čtyři měsíce před početím.
Pokud jde o riziko reaktivace RS u matky, modulátory S1PR by neměly být vysazeny bez náhradní terapie. Anti-CD20 léky se jeví jako zajímavá „překlenovací terapie“. CLA zůstává možností, pokud není plánováno těhotenství v krátkodobém horizontu. Méně účinné léky, jako jsou IFN/GA nebo fumaráty, lze zvážit, pokud byla aktivita onemocnění před početím relativně nízká. Tato strategie bude pravděpodobně horší než HET, ale lepší než žádná k prevenci relapsu. Pokud se v těhotenství (do 30–34 týdnů) pokračuje v léčbě NTZ, doporučuje se prodloužit interval mezi jednotlivými dávkami na každých 6–8 týdnů a léčbu obnovit nejpozději za dva týdny po porodu. Pokud je léčba NTZ z jakéhokoli důvodu přerušena před otěhotněním, měla by být zahájena překlenovací léčba, nejlépe anti-CD20 přípravkem.
Opětovné zahájení DMT po porodu souvisí s problematikou kojení. Obecně by se od kojení nemělo odrazovat, ale není slučitelné s opětovným zahájením perorální DMT (TRF, fumaráty, modulátory S1PR), což jsou malé molekuly, které přecházejí do mléka.
Pro užívání během kojení jsou oficiálně schváleny pouze tři DMT: IFNβ, GA a OFA.
Monitoring deeskalace u RS
Monitoring aktivity a progrese RS po deeskalaci vyžaduje systematický a multidimenzionální přístup. V rámci čtyř randomizovaných kontrolovaných studií zaměřených na deeskalaci byly vybrány různé výstupy, které zahrnují klinické výsledky hodnotící výskyt relapsů a neurologické postižení, radiologické výsledky pomocí MR mozku, biologické výsledky pomocí stanovení hladiny lehkých řetězců neurofilament (NfL) v krvi a výsledky související s pacientem týkající se kvality života, úzkosti, deprese a zátěže léčbou.
Obecná doporučení pro monitorování pacientů by měla být nezávislá na věku, délce trvání onemocnění, fenotypu, závažnosti RS a typu DMT. Doporučuje se sledovat klinické výsledky hodnotící výskyt relapsů a neurologické postižení, ideálně doplněné o pacientské výsledky. Při deeskalaci se doporučuje základní vyšetření MR mozku a míchy. Frekvence a délka radiologického sledování by však měly být přizpůsobeny každé situaci.
V posledních letech se objevila snaha o využití digitálních prostředků v managementu pacientů s RS, což by mohlo umožnit sledování symptomů v přirozeném prostředí pacienta. V kontextu monitorování deeskalace však tyto metody vyžadují další hodnocení.
Biologické markery jako NfL silně souvisejí s aktivitou onemocnění a účinností léčby, ale jejich věkově závislý nárůst může omezit diagnostické využití na individuální úrovni. Na druhou stranu hladiny gliového fibrilárního kyselého proteinu (GFAP) korelují s progresí onemocnění, a to v mozkomíšním moku i v séru.
Závěr a budoucí směry
V průběhu života pacienta se přirozený průběh RS mění, dochází k menšímu počtu relapsů a ke snížení aktivity na MR, ale zvyšuje se riziko progrese. Totéž platí pro poměr přínosu a rizika v současnosti dostupných DMT, který se s věkem stává méně příznivým a je třeba jej pravidelně přehodnocovat. Věk pacienta je proto nejdůležitějším kritériem pro zvažování deeskalace. Ačkoli neexistuje shoda, zdá se, že hraničním věkem je nejméně 55 let a možná i více. Obezřetná deeskalace také vyžaduje, aby po dobu průměrně pěti let nebyly přítomny žádné klinické nebo radiologické známky aktivity onemocnění. K potvrzení těchto prahových hodnot je zapotřebí výsledků dalších randomizovaných studií.
Při rozhodování je třeba respektovat nejen obecná kritéria, ale i specifické faktory každého pacienta, jako je jeho ochota, závažnost postižení, komorbidity, stav JCV, hypogamaglobulinemie a další, jež mohou zvyšovat rizika léčby. V každém případě by rozhodnutí mělo být výsledkem sdíleného procesu mezi pacienty a lékaři.
Strategie deeskalace závisí především na typu použité DMT, zejména na jejím potenciálním riziku RF. Přibývá důkazů podporujících strategii odstupňování dávek u monoklonálních protilátek. Byly navrženy i další zajímavé přístupy, které se v současnosti vyhodnocují, jako například použití jediné infuze anti-CD20 po ukončení léčby NTZ nebo modulátorem S1PR nebo použití CLA jako výstupní terapie u starších pacientů.
Neexistuje shoda ohledně povahy, frekvence a délky monitorování po deeskalaci kromě toho, že je to povinné. Deeskalace není ukončením péče a pacienti by to tak neměli vnímat. Budoucí úsilí by mělo směřovat k posouzení dopadu deeskalace DMT na bezpečnostní výsledky i na progresi onemocnění, zejména na méně viditelné parametry, jako je únava nebo kognitivní poruchy. V tomto kontextu by byly zvlášť zajímavé biomarkery a hodnocení pacientem, které lze využít v klinické praxi.
Reference:
Androdias G, et al. De-escalating and discontinuing disease-modifying therapies in multiple sclerosis. Brain 2024 Dec 21:awae409. doi: 10.1093/brain/awae409. Epub ahead of print. PMID: 39707906.